VINCRISTIN SULFAT (Vincristini sulfas) – Dược Điển Việt Nam 5
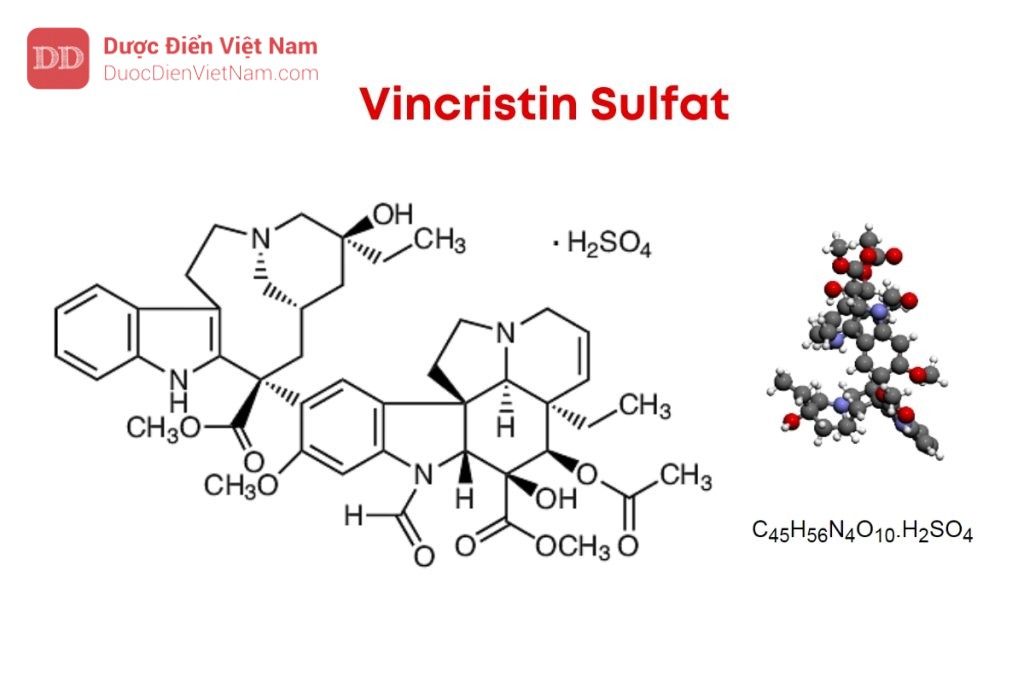
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyVincristin sulfat là methyl (3aR,4R,5S,5aR,10bR,13aR)-4-(acetyloxy)-3aethyl-9-[(5S,7R,9S)-5-ethyl-5-hydroxy- 9-(methoxycarbonyl)-1,4,5,6,7,8,9,10-octahydro-2H-3,7- methanoazacycloundecino[5,4-b]indol-9-yl]-6-formyl-5-hydroxy-8-methoxy-3a,4,5,5a,6,11,12,13a-octahydro-1H– indolizino[8,1-cd]carbazol-5-carboxylat sulfat, phải chứa từ 95,0 % đến 104,0 % C46H56N4O10.H2SO4 tính theo chế phẩm đã làm khô.
Tính chất
Bột kết tinh trắng hoặc hơi vàng nhạt, rất dễ hút ẩm. Dễ tan trong nước, khó tan trong ethanol 96 %.
Định tính
Phổ hấp thụ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hấp thụ hồng ngoại đối chiếu của vincristin sulfat chuẩn.
Độ trong và màu sắc
Dung dịch S: Hòa tan 50,0 mg chế phẩm trong nước không có carbon dioxyd (TT) và pha loãng thành 10,0 ml bằng cùng dung môi. Dung dịch S được bảo quản trong nước đá để tiến hành phép thử Tạp chất liên quan.
Dung dịch S phải trong (Phụ lục 9.2) và màu không được đậm hơn màu mẫu V7 (Phụ lục 9.3, phương pháp 1).
pH
Pha loãng 2 ml dung dịch S thành 10 ml bằng nước không có carbon dioxyd (TT), dung dịch thu được phải có pH từ 3,5 đến 4,5 (Phụ lục 6.2).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động A: Dung dịch diethylamin 1,5 % (tt/tt) đã được điều chỉnh đến pH 7,5 bằng acid phosphoric (TT).
Pha động B: Methanol (TT).
Dung dịch thử: Pha loãng 1,0 ml dung dịch S thành 5,0 ml bằng nước.
Dung dịch đối chiếu (1): Hòa tan 5,0 mg vincristin sulfat chuẩn trong nước để được 5,0 ml.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch thử thành 50,0 ml bằng nước.
Dung dịch đối chiếu (3): Pha loãng 1,0 ml dung địch đối chiếu (2) thành 20,0 ml bằng nước.
Dung dịch phân giải: Hòa tan 1,0 mg vinblastin sulfat chuẩn trong 1,0 ml dung dịch đối chiếu (1).
Bảo quản các dung dịch trên trong nước đá trước khi dùng.
Điều kiện sắc ký:
- Cột kích thước (25 cm x 4,6 mm) được nhồi pha tĩnh B (5 µm) (cột Zorbax C8 là thích hợp).
- Tiền cột được nhồi pha tĩnh B.
- Detector quang phổ tử ngoại ở bước sóng 297 nm.
- Tốc độ dòng: 2 ml/min.
- Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiến hành sắc ký theo chương trình dung môi như sau:
| Thời gian (min) | Pha động A (%tt/tt) | Pha động B (%tt/tt) |
| 0-12 | 38 | 62 |
| 12-27 | 38 -> 8 | 62 -> 92 |
| 27-29 | 8 -> 38 | 92 -> 62 |
| 29-34 | 38 | 62 |
Kiểm tra tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch phân giải, độ phân giải giữa pic vincristin và vinblastin ít nhất là 4.
Giới hạn: Trên sắc ký đồ của dung dịch thử:
Diện tích của bất kỳ pic phụ nào đều không được lớn hơn diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (2,0%).
Tổng diện tích của các pic phụ không được lớn hơn 2,5 lần diện tích của pic chính trên sắc ký đồ của dung địch đối chiếu (2) (5,0 %).
Bỏ qua các pic phụ có diện tích nhỏ hơn diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu (3) (0.1 %).
Mất khối lượng do làm khô
Không được quá 12,0 % (Phụ lục 9.6).
(0,0500 g; chân không; 105°C; 2 h).
Xem thêm: BỘT PHA TIÊM VINCRISTIN SULFAT (Vincristini sulfatis pro Injectione) – Dược Điển Việt Nam 5
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3), Điều kiện sắc ký như mô tả trong phần Tạp chất liên quan, với những thay đổi như sau:
Pha động: Methanol – dung dịch diethylamin 1,5% (tt/tt) đã được điều chỉnh đến pH 7,5 bằng acid phosphoric (7 : 3).
Tốc độ dòng: 1 ml/min.
Tính hàm lượng phần trăm của C46H56N4O10.H2SO4 theo diện tích của pic chính trên sắc ký đồ của dung dịch thử và dung dịch đổi chiếu (1) và hàm lượng đã biết của vincristin sulfat chuẩn.
Thử vô khuẩn
Nếu chế phẩm dự định dùng để sản xuất thuốc tiêm phân liều mà không tiến hành tiệt khuẩn nữa thì phải đáp ứng phép thử này (Phụ lục 13.7).
Bảo quản
Trong bình thủy tinh kín, tránh ánh sáng và bảo quản ở nhiệt độ không quá -20 °C. Nếu chế phẩm là vô khuẩn thì phải đựng trong bình thủy tinh vô khuẩn, đậy thật kín để tránh nhiễm vi khuẩn. Trên nhãn cần ghi rõ chế phẩm là vô khuẩn hay không.
Loại thuốc
Chống ung thư.
Chế phẩm
Thuốc tiêm.