PARACETAMOL (Paracetamolum) – Dược Điển Việt Nam 5
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyParacetamol là N-(4-hydroxyphenyl) acetamid, phải chứa từ 99,0 % đến 101,0 % C8H9NO2, tính theo chế phẩm đã làm khô.
CTHH: C8H9NO2
P.t.l: 151,2
Tính chất
Bột kết tinh trắng, không mùi. Hơi tan trong nước, rất khó tan trong cloroform, ether, methylen clorid, dễ tan trong dung dịch kiềm, ethanol 96 %.
Định tính
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, C.
Nhóm Il: B, C, D, E.
A. Phổ hấp thụ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hấp thụ hồng ngoại của paracetamol chuẩn.
B. Hòa tan 0,1 g chế phẩm trong methanol (TT) và pha loãng thành 100,0 ml với cùng dung môi. Lấy 1,0 ml dung dịch, thêm 0,5 ml dung dịch acid hydrocloric 0,1 M (TT) thêm methanol (TT) thành 100,0 ml. Bảo quản dung dịch này tránh ánh sáng và đem đo ngay độ hấp thụ (Phụ lục 4.1) ở bước sóng cực đại 249 nm. A(1 %, 1 cm) phải trong khoảng 860 đến 980.
C. Điểm chảy (Phụ lục 6.7): Từ 168 °C đến 172 °C
D. Đun nóng 0,1 g chế phẩm trong 1 ml acid hydrocloric (TT) trong 3 min, thêm 1 ml nước, làm lạnh trong đá, không có tủa tạo thành. Thêm 0,05 ml dung dịch kali dicromat 0,49 %, xuất hiện màu tím và không chuyển sang màu đỏ.
E. Chế phẩm phải cho phản ứng của nhóm acetyl (Phụ lục 8.1) . Thực hiện phản ứng bằng cách đun trực tiếp trên lửa.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3). Các dung dịch được chuẩn bị ngay khi tiến hành thử nghiệm.
Pha động: Hỗn hợp gồm 375 thể tích dung dịch dinatri hydrophosphat 1,79 %, 375 thể tích dung dịch natri dihydrophosphat 0,78 % và 250 thể tích methanol (TT) có chứa 0,46 % của dung dịch tetrabutylamoni hydroxid 40%.
Dung dịch thử: Hòa tan 0,200 g chế phẩm trong 2,5 ml methanol (TT) có chứa 0,46 % dung dịch tetrabutylamoni hydroxyd 40 % và pha loãng thành 10,0 ml với hỗn hợp đồng thể tích của dung dịch dinatri hydrophosphat 1, 79 % và dung dịch natri dihydrophosphat 0,78 %.
Dung dịch đối chiếu (1): Pha loãng 1,0 ml dung dịch thử thành 50,0 ml bằng pha động. Pha loãng 5,0 ml dung dịch thu được thành 100,0 ml với pha động.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch đối chiếu (1) thành 10,0 ml bằng pha động.
Dung dịch đối chiếu (3): Hòa tan 5,0 mg 4-aminophenol (TT), 5 mg paracetamol chuẩn và 5,0 mg cloroacetanilid (TT) trong methanol (TT) và pha loãng thành 20,0 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 250,0 ml với pha động.
Dung dịch đối chiếu (4): Hòa tan 20,0 mg 4-nitrophenol (TT) trong methanol (TT) và pha loãng thành 50,0 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 20.0 ml bằng pha động.
Điều kiện sắc ký:
Cột kích thước (25 cm x 4,6 mm) được nhồi pha tĩnh B (5 μm).
Nhiệt độ cột: 35 °C.
Detector quang phổ tử ngoại ở bước sóng 245 nm.
Tốc độ dòng: 1,5 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Tiến hành sắc ký với thời gian gấp 12 lần thời gian lưu của pic paracetamol.
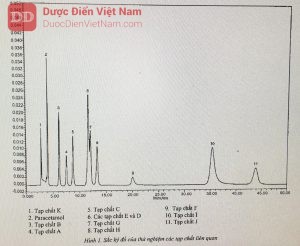
Thời gian lưu tương đối so paracetamol (thời gian lưu khoảng 4 min): Tạp chất K khoảng 0,8; tạp chất F khoảng 3; tạp chất J khoảng 7.
Kiểm tra tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch đối chiếu (3), độ phân giải giữa pic của tạp chất K và pic của paracetamol ít nhất là 4; tỉ lệ giữa tín hiệu và nhiễu cho pic của tạp chất J ít nhất là 50.
Giới hạn: Trên sắc ký đồ của dung dịch thử:
Tạp chất J: Diện tích pic tạp chất J không được lớn hơn 0,2 lần diện tích pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu (3) (10 phần triệu).
Tạp chất K: Diện tích pic tạp chất K không được lớn hơn diện tích pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu (3) (50 phần triệu).
Tạp chất F: Diện tích pic tạp chất F không được lớn hơn 0,5 lần diện tích pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu (4) (0,05%).
Tạp chất khác: Với mỗi tạp chất, diện tích pic không được lớn hơn 0,5 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (1) (0,05 %).
Tổng diện tích pic của tất cả các tạp chất không được lớn hơn diện tích pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu ( q) (0,1 %).
Bỏ qua những pic có diện tích nhỏ hơn 0,5 lần diện tích pic chính thu được trên sắc ký đồ của dung dịch đối chiếu (2) (0,01%).
Ghi chú:
Tạp chất A: N-(2-hydroxyphenyl)acetamid
Tạp chất B: N-(4-hydroxyphenyl)propanamid
Tạp chất C: N-(3-cloro-4-hydroxyphenyl)acetamid
Tạp chất D: N-phenylacetamid
Tạp chất E: 1-(4-hydroxyphenyl)ethanon
Tạp chất F: 4-nitrophenol
Tạp chất G: 1-(4-hydroxyphenyl)ethanon oxim
Tạp chất H: 4-(acetylamino)phenyl acetat
Tạp chất I: 1-(2-hydroxyphenyl)ethanon
Tạp chất J: N-(4-clorophenyl)acetamid (cloroacetanilid)
Tạp chất K: 4-aminophenol.
Xem thêm: VIÊN NÉN PAPAVERIN HYDROCLORID (Tabellae Papaverini hydrochloridi) – Dược Điển Việt Nam 5
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8).
Hòa tan 1,0 g chế phẩm trong hỗn hợp nước – aceton (15 : 85) và pha loãng thành 20,0 ml với cùng hỗn hợp dung môi. Lấy 12 ml dung dịch nàỵ thử theo phương pháp 2. Dùng dung dịch chì mẫu 1 phần triệu thu được bằng cách pha loãng dung dịch chì mẫu 100 phần triệu (TT) với hỗn hợp dung môi trên để chuẩn bị mẫu đối chiếu.
Mất khối lượng do làm khô
Không được quá 0,5 % (Phụ lục 9.6).
Dùng 1,000 g chế phẩm; sấy ở 100 °C đến 105 °C.
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,300 g chế phẩm trong hỗn hợp gồm 10 ml nước và 30 ml dung dich acid sulfuric loãng (TT). Đun sôi hồi lưu trong 1 h, làm lạnh và pha loãng thành 100,0 ml bằng nước. Lấy 20,0 ml dung dịch, thêm 40 ml nước, 40 g nước đá, 15 ml dung dịch acid hydrocloric loãng (TT) và 0,1 ml dung dịch feroin (TT). Định lượng bằng dung dịch amoni ceri sulfat 0,1 M (CĐ) cho đến khi xuất hiện màu vàng lục. Song song tiến hành mẫu trắng trong cùng điều kiện.
1 ml dung dịch amoni ceri sulfat 0,1 M (CĐ) tương đương với 7,56 mg C8H9NO2.
Bảo quản
Trong bao bì kín, tránh ánh sáng.
Loại thuốc
Hạ sốt, giảm đau.
Chế phẩm
Viên nén, nang, hỗn dịch uống, dung dịch uống, viên nén sủi, viên đặt, thuốc tiêm truyền.