Dư lượng hóa chất bảo vệ thực vật (Phụ lục 12.17) – Dược điển Việt Nam 5
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyĐịnh nghĩa
Hóa chất bảo vệ thực vật là những chất hay hỗn hợp nhiều chất được sử dụng nhằm ngăn cản, tiêu diệt hoặc kiểm soát dịch hại đối với các loại cây hoặc động vật làm thuốc mà những chất này có thể gây tổn hại hoặc ảnh hưởng đến quá trình sản xuất, chế biến, bảo quản, vận chuyển hoặc buôn bán dược liệu. Khái niệm này bao gồm cả các chất điều hòa sinh trưởng thực vật, các chất làm rụng lá hoặc làm khô, hoặc bất cứ chất nào được sử dụng trước hoặc sau thu hoạch để bảo quản dược liệu khỏi bị hỏng trong quá trình bảo quản hoặc vận chuyển.
Giới hạn
Dược liệu được kiểm tra ít nhất phải đáp ứng yêu cầu về giới hạn ghi trong Bảng 12.17.1 (trừ những chỉ dẫn trong chuyên luận riêng).
Đối với hóa chất bảo vệ thực vật không liệt kê trong Bảng 12.17.1, giới hạn (mg/kg) của nó có thể được tính theo công thức sau:
(ADI x M)/(MDD x 100)
Trong đó:
ADI (mg/kg) là liều có thể đưa vào cơ thể mỗi ngày theo quy định của Tổ chức Lương thực Thế giới và Tổ chức Y tế thế giới (Codex Alimentarius, FAO — WHO);
M là thể trọng của người, bằng 60 kg;
MDD là liều dùng dược liệu hàng ngày, tính bằng kg.
Xem thêm: Xác định tạp chất lẫn trong dược liệu (Phụ lục 12.11) – Dược điển Việt Nam 5
Lấy mẫu
Phương pháp:
Bao bì ít hơn 1 kg, trộn đều và lấy đủ lượng mẫu để phân tích. Bao bì từ 1 kg đến 5 kg, lấy những lượng tương đương và đủ để phân tích ở 3 vị trí: Phía trên, giữa và cuối bao bì. Trộn đều và lấy lượng mẫu đủ để phân tích. Bao bì lớn hơn 5 kg, lấy không ít hơn 250 g ở 3 vị trí: phía trên, giữa và cuối bao bì, trộn đều và lấy một lượng mẫu đủ để phân tích.
Số mẫu:
Nếu như số bao bì (n) ít hơn hoặc bằng 3, mỗi bao bì lấy một lượng mẫu theo phương pháp nêu trên. Nếu số bao bì lớn hơn 3, số mẫu cần lấy sẽ là căn bậc hai của n + 1, làm tròn số đến đơn vị số nguyên gần nhất.
Mẫu cần được phân tích ngay để tránh hóa chất bảo vệ thực vật có thể bị phân hủy. Nếu như không tiến hành phân tích ngay được, mẫu phải được bảo quản kín trong bao bì loại thích hợp dùng để đựng thực phẩm, ở nhiệt độ dưới 0 °C và tránh ánh sáng.
Thuốc thử
Tất cả các thuốc thử và dung môi không được nhiễm hóa chất bảo vệ thực vật. Nếu có thể, thường phải sử dụng các dung môi loại chất lượng đặc biệt, nếu không, các dung môi sử dụng cần phải mới được cất lại trong dụng cụ hoàn toàn bằng thủy tinh. Trong bất cứ trường hợp nào, cũng cần phải thực hiện kiểm tra mẫu trắng.
Dụng cụ
Rửa sạch dụng cụ, đặc biệt đối với dụng cụ thủy tinh để đảm bảo chúng sạch không có hóa chất bảo vệ thực vật, ví dụ ngâm trong dung dịch xà phòng không có phosphat ít nhất 16 h, rửa bằng nước cất nhiều lần đến sạch, tráng rửa bằng aceton và hexan hoặc heptan.

Phân tích định tính và định lượng hóa chất bảo vệ thực vật tồn dư
Quy trình phân tích áp dụng phải được kiểm định và chuẩn hóa theo quy chế hiện hành, đặc biệt, nó phải đáp ứng các yêu cầu dưới đây:
(a) Phương pháp lựa chọn, đặc biệt các bước xử lý làm sạch chất phân tích phải thích hợp đối với chất cần phân tích và không bị ảnh hưởng bởi các chất khác chiết cùng; giới hạn phát hiện và giới hạn định lượng được xác định đối với mỗi hóa chất bảo vệ thực vật và dựa trên nền của mẫu phân tích.
(b) Tỷ lệ thu hồi đối với mỗi hóa chất bảo vệ thực vật phải nằm trong khoảng 70 % đến 110 %.
(c) Độ lặp lại của phương pháp không được thấp hơn các giá trị ghi trong Bảng 12.17.2.
(d) Độ tái lặp của phương pháp không được thấp hơn các giá trị ghi trong Bảng 12.17.2.
(e) Nồng độ của các dung dịch thử, dung dịch đối chiếu và các thông số phân tích cài đặt trên máy phải tương ứng với đáp ứng tuyến tính của detector phân tích.
Bảng 12.17.2
| Nồng độ chất phân tích
(mg/kg) |
Độ lặp lại
RSD (%) |
Độ tái lặp lại
(%) |
| 0.001 – 0.010 | 30 | 60 |
| > 0.010 – 0.100 | 20 | 60 |
| > 0.100 – 1.000 | 15 | 30 |
| > 1.000 | 10 | 20 |
Ghi chú:
Độ lặp lại (Repeatability): Độ chụm trong điều kiện các kết quả thử nghiệm độc lập với cùng một phương pháp, trên những mẫu giống hệt nhau, trong cùng phòng thí nghiệm, bởi cùng người thao tác, sử dụng cùng một thiết bị, trong khoảng thời gian ngắn.
Độ tái lặp (Reproducibility): Độ chụm trong điều kiện các kết quả thử nghiệm nhận được bởi cùng một phương pháp, trên các mẫu thử giống hệt nhau trong các phòng thí nghiệm khác nhau, với những người thao tác khác nhau, sử dụng thiết bị khác nhau.
Xem thêm: Định tính dược liệu và các chế phẩm bằng kính hiển vi (Phụ lục 12.18) – Dược điển Việt Nam 5
Phương pháp phân tích dưới đây nhằm cung cấp thông tin để tham khảo:
Xác định dư lượng hóa chất bảo vệ thực vật nhóm clor hữu cơ, nhóm phosphor hữu cơ và nhóm pyrethroid
Phương pháp dưới đây có thể được sử dụng. Tùy theo chất cần phân tích, nếu cần thiết có thể thay đổi quy trình phân tích mô tả dưới đây. Trong mọi trường hợp, đều có thể sử dụng bổ sung một loại cột khác có độ phân cực khác hoặc phương pháp phát hiện khác (ví dụ detector khối phổ) hoặc phương pháp phân tích khác (ví dụ phương pháp hóa miễn dịch) để khẳng định kết quả thu được.
1. Chiết
Thêm 100 ml aceton (TT) vào 10 g mẫu thử đã được làm thành bột thô và để yên 20 min. Thêm 1 ml dung dịch có chứa carbophenothion 1,8 μg/ml trong toluen (TT). Làm đồng nhất trong 3 min, sử dụng máy khuấy trộn tốc độ cao. Lọc và rửa cốc hai lần, mỗi lần với 25 ml aceton (TT).Gộp dịch chiết và dịch rửa, làm bay hơi dung môi ở nhiệt độ không quá 40 °C trong máy cất quay cho tới khi dung môi bị loại hầu như hoàn toàn. Thêm vào cắn vài mililít toluen (TT), tiếp tục làm bay hơi đến khi dung môi bị loại bỏ hầu như hoàn toàn. Hòa tan cắn trong 8 ml toluen (TT).
Lọc qua màng lọc 45 μm, rửa bình, dụng cụ lọc và làm vừa đủ 10 ml bằng toluen (TT) (dung dịch A).
2. Làm sạch
2.1. Hóa chất bản vệ thực vật nhóm clor hữu cơ, nhóm phosphor hữu cơ và nhóm pyrethroid
Tiến hành phương pháp sắc ký rây phân tử (Phụ lục 5.5).
Điều kiện sắc ký:
Cột thép không gỉ (0,30 m x 7,8 mm), pha tĩnh copolymer styren – divinylbenzen (5 μm) (TT), sử dụng toluen (TT) làm pha động với tốc độ dòng 1 ml/min.
Hiệu năng của cột: Tiêm 100 μl dung dịch có chứa đỏ methyl 0,05 % (TT) và oracet lam 2 R 0,05 % (TT) trong toluen (TT) vào hệ thống sắc ký. Cột chỉ thích hợp khi màu của dịch rửa giải thay đổi từ màu cam sang màu xanh da trời ở thể tích rửa giải 10,3 ml. Nếu cần chuẩn hóa cột, có thể sử dụng dung dịch pha trong toluen có chứa chất phân tích ở nồng độ thích hợp là chất có phân tử lượng thấp nhất (ví dụ dicloryos) và chất có phân tử lượng cao nhất (ví dụ deltamethrin). Xác định đoạn dung môi rửa giải có chứa cả hai chất.
Làm sạch dung dịch thử: Tiêm một thể tích xác định dung dịch A (100 μl đến 500 μl) vào hệ thống và tiến hành chạy sắc ký. Thu đoạn dung môi rửa giải đã xác định ở trên (dung dịch B). Các chất nhóm phosphor hữu cơ thường được rửa giải ở đoạn từ 8,8 ml đến 10,9 ml, Các chất nhóm clor hữu cơ và nhóm pyrethroid thường được rửa giải ở đoạn 8,5 ml đến 10,3 ml.
2.2. Hóa chất bảo vệ thực vật nhóm clor hữu cơ và nhóm pyrethroid
Cho một ít bông không có chất béo vào cột sắc ký (0,10 m x 5 mm), sau đó cho 0,5 g silica gel đã được xử lý vào cột. Xử lý silica gel như sau: sấy silica gel dùng cho sắc ký trong tủ sấy ở 150 °C trong 4 h, Để nguội và thêm vào đó từng giọt một lượng nước tương ứng với 1,5 % khối lượng silica gel đem sấy. Lắc mạnh cho đến khi không còn các cục vón, tiếp tục lắc trên máy lắc cơ học trong 2 h. Luyện cột bằng 1,5 ml hexan (TT). Cột loại nhồi sẵn có chứa 500 mg silica gel loại thích hợp có thể được sử dụng, miễn là loại cột này đã được kiểm tra và chuẩn hóa trước.
Đuổi dung môi trong dung dịch B dưới luồng khí heli (TT) hoặc khí nitrogen không có oxy (TT) tới khi dung môi hầu như bị loại hoàn toàn, hòa tan cắn trong một thể tích toluen (TT) thích hợp (từ 200 μl đến 1 ml tùy theo thể tích dung dịch A đã tiêm ở giai đoạn thực hiện sắc ký rây phân tử).
Chuyển toàn bộ dung dịch lên cột và tiến hành sắc ký, sử dụng 1,8 ml toluen (TT) làm pha động. Thu hồi dịch rửa giải (dung dịch C).
3. Định lượng
3.1. Hóa chất bảo vệ thực vật nhóm phosphor hữu cơ
Tiến hành phân tích sắc ký khí (Phụ lục 5.2), sử dụng carbophenothion (TT) làm chuẩn nội. Nếu cần thiết, có thể sử dụng một chất chuẩn nội thứ hai để phân biệt khi có ảnh hưởng với pic của carbopbenothion.
Dung dịch thử: Làm bay hơi dung dịch B dưới luồng khí heli (TT) gần tới khô hoàn toàn và hòa tan cắn trong 100 μl toluen (TT).
Dung dịch đối chiếu: Pha ít nhất 3 dung dịch có chứa các hóa chất bảo vệ thực vật cần xác định và carbophenothion ở nồng độ thích hợp để thiết lập đường chuẩn.
Điều kiện sắc ký:
Cột: Cột silica nung chảy (30 m x 0,32 mm) phủ lớp pha tĩnh poly(dimethyl)siloxan (TT) dày 0,25 μm.
Khí mang hydrogen (TT), các khí mang khác như heli (TT) hoặc nitrogen (TT) cũng có thể sử dụng được, miễn là hệ thống sắc ký được chuẩn hóa một cách phù hợp.
Detector ion hóa ngọn lửa phosphor – nitrogen hoặc detector quang kế ngọn lửa.
Chương trình nhiệt độ buồng cột: Duy trì nhiệt độ 80 °C trong 1 min, tăng 30 °C/min tới 150 °C, duy trì trong 3 min, tăng 4 °C/min tới 280 °C và duy trì trong 1 min. Nhiệt độ cổng tiêm 250 °C, nhiệt độ detector 275 °C.
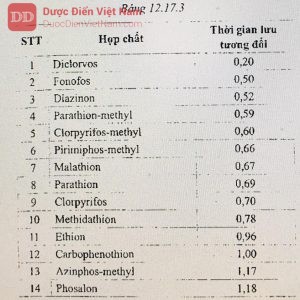
Thể tích tiêm: Tiêm một thể tích xác định các dung dịch, sắc ký đồ thu được với điều kiện mô tả trên sẽ cho kết quả thời gian lưu tương đối xấp xỉ các giá trị liệt kê ở Bảng 12.17.3.
Tính kết quả dựa vào diện tích pic và nồng độ của các dung dịch.
3.2. Hóa chất bảo vệ thực vật nhóm clor hữu cơ và pyrethroid
Tiến hành phân tích sắc ký khí (Phụ lục 5.2), sử dụng carbophenothion (TT) làm chuẩn nội. Nếu cần thiết, có thể sử dụng một chất chuẩn nội thứ hai để phân biệt khi có ảnh hưởng với pic của carbophenothion.
Dung dịch thử: Làm bay hơi dung dịch C dưới luồng khí heli (TT) hoặc khí nitrogen không có oxy (TT) gần tới khô hoàn toàn và hòa tan cắn trong 500 μl toluen (TT).
Dung dịch đối chiếu: Pha ít nhất 3 dung dịch có chứa các hóa chất bảo vệ thực vật cần xác định và carbophenothion ở nồng độ thích hợp để thiết lập đường chuẩn.
Điều kiện sắc ký:
Cột silica nung chảy (30 m x 0,32 mm) phủ lớp pha tĩnh poly(dimethyl)(diphenyl)siloxan (TT) dày 0,25 μm.
Khí mang hydrogen (TT), các khí mang khác như heli (TT) hoặc nitrogen (TT) cũng có thể sử dụng được miễn là hệ thống sắc ký được chuẩn hóa một cách phù hợp.
Detector cộng kết điện tử.
Chương trình nhiệt độ buồng cột: Duy trì nhiệt độ 80 °C trong 1 min, tăng 30 °C/min tới 150 °C, duy trì trong 3 min, tăng 4 °C/min tới 280 °C và duy trì trong 1 min. Nhiệt độ công tiêm 250 °C, nhiệt độ detector 275 °C,
Thể tích tiêm: Tiêm một thể tích xác định các dung dịch.
Sắc ký đồ thu được với điều kiện mô tả trên sẽ cho kết quả thời gian lưu lượng đối xấp xỉ các giá trị liệt kê ở Bảng 12.17.4.
Tính kết quả dựa vào diện tích pic và nồng độ các dung dịch.