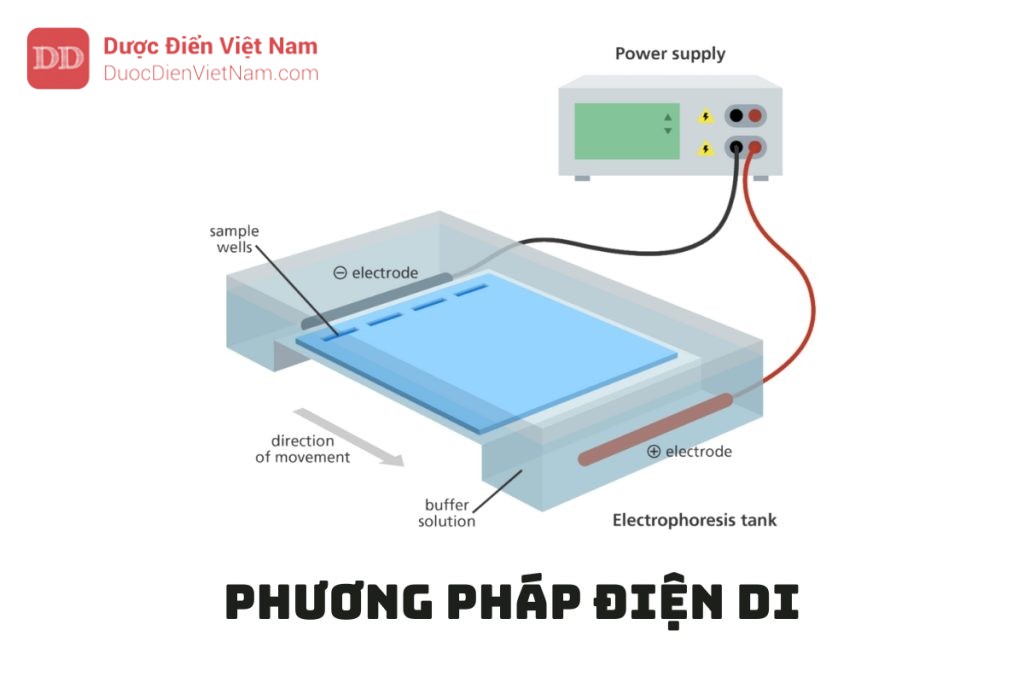
PHƯƠNG PHÁP ĐIỆN DI (Phụ lục 5.6) – Dược Điển Việt Nam 5
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyĐiện di là hiện tượng liên quan đến sự di chuyển của các protein, các colloid, các phân tử, hay các tiểu phân tích điện hòa tan hoặc phân tán trong dung dịch điện giải khi có dòng điện đi qua.
Điện di được chia thành hai loại tùy theo thiết bị sử dụng: Điện di dung dịch tự do hay điện di với sự chuyển dịch của các lớp biên và điện di vùng.
Trong phương pháp điện di dung dịch tự do, dung dịch đệm của các protein trong một ống hình chữ U dưới tác dụng của dòng điện sẽ hình thành nên các lớp protein có linh độ giảm dần. Chỉ phần di chuyển nhanh nhất của protein sẽ tách rõ rệt khỏi các protein khác, kiểm tra sự dịch chuyển của các lớp biên bằng hệ thống quang học sẽ cung cấp các dữ liệu để tính toán linh độ điện di và các thông tin về mặt định tính và định lượng của thành phần hỗn hợp protein.
Trong điện di vùng, mẫu được đưa vào dưới dạng một dải hẹp hay điểm trong cột, trên tấm phẳng, hay trên một lớp phim chứa đệm. Sự di chuyển của các thành phần trong các dải hẹp cho phép tách hoàn toàn chúng. Có thể tránh sự chồng lấn giữa các dải hẹp do sự đối lưu nhiệt bằng cách đưa chất điện giải vào các nền (matrix) xốp như chất rắn dạng bột, hay nguyên liệu dạng sợi như giấy, hay gel như tinh bột, agar hoặc polyacrylamid.
Các phương pháp điện di vùng có ứng dụng rộng rãi. Điện di gel, đặc biệt là điện di đĩa được sử dụng để tách protein do khả năng cho độ phân giải cao.
Sự di chuyển điện di của các tiểu phân của một chất nhất định phụ thuộc vào tính chất của tiểu phân mà chủ yếu là điện tích, kích thước hay khối lượng phân tử và hình dạng của các tiểu phân cũng như các tính chất và các thông số thực nghiệm của hệ thống. Những thông số này bao gồm: pH, nồng độ ion, độ nhớt và nhiệt độ của chất điện giải, mật độ hoặc độ liên kết chéo của các matrix nền như gel và điện thế áp đặt.
Ảnh hưởng của điện tích, kích thước tiểu phân, độ nhớt của chất điện giải và biến thiên điện thế
Các tiểu phân tích điện sẽ di chuyển về phía điện cực ngược dấu với chúng, sự di chuyển của các phân tử tích cả điện dương và điện âm phụ thuộc vào điện tích mạng. Tốc độ di chuyển tỷ lệ thuận với độ lớn của điện tích mạng trên tiểu phân và tỷ lệ nghịch với kích thước tiểu phân, mà kích thước tiểu phân lại có liên quan trực tiếp với phân tử lượng.
Những tiểu phân hình cầu lớn, khi định luật Stoke có giá trị, linh độ điện di μ0 sẽ tỷ lệ nghịch với bán kính của tiểu phân theo phương trình:
μ0 = (V/E) = Q/(6Πrη)
Trong đó V là vận tốc của tiểu phân, E là thế đặt lên chất điện giải, Q là điện tích của tiểu phân, r là bán kính tiểu phân và η là độ nhớt của dung dịch chất điện giải.
Phương trình này chỉ có giá trị giới hạn ở độ pha loãng nhất định và không có sự hiện diện của các nền như giấy hoặc gel. Các ion và peptid có trọng lượng phân tử lớn hơn 5000, đặc biệt khi có mặt môi trường nền, không tuân theo định luật Stoke và linh độ điện di của chúng được biểu thị bằng phương trình:
μ0 = Q/(AΠr2η)
Trong đó A là thừa số hình dạng, thay đổi trong khoảng từ 4 – 6, biểu thị sự phụ thuộc tỷ lệ nghịch của linh độ điện di đối với bình phương bán kính tiểu phân, về mặt khối lượng phân tử, linh độ điện di sẽ tỷ lệ nghịch với căn bậc ba của bình phương khối lượng phân tử.
Ảnh hưởng của pH
Hướng và tốc độ di chuyển của phân tử có nhiều nhóm chức có thể bị ion hóa như acid amin và protein sẽ phụ thuộc vào pH của dung dịch chất điện giải. Ví dụ:
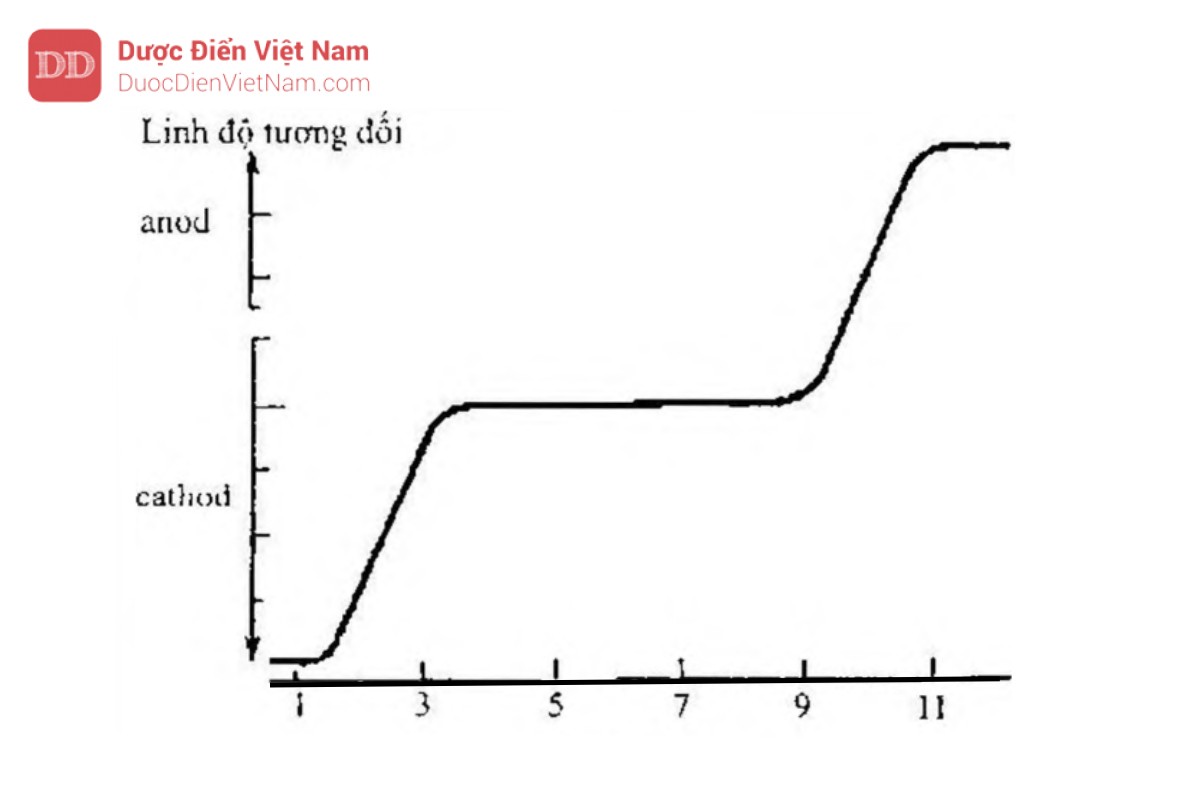
Giá trị pKa bằng 2,2 và 9,9 trùng với điểm uốn trên biểu đồ. Do nhóm chức bị ion hóa 50 % ở giá trị pH = pKa, nên linh độ điện di ở những điểm này sẽ bằng 1/2 giá trị quan sát được khi cation và anion bị ion hóa hoàn toàn lần lượt ở pH rất thấp và pH rất cao. Ion lưỡng cực tồn tại ở khoảng pH trung gian là những chất trung hòa về điện và có linh độ điện di bằng 0.
=> Tham khảo: PHƯƠNG PHÁP SẮC KÝ LỚP MỎNG (Phụ lục 5.4) – Dược Điển Việt Nam 5.
Ảnh hưởng của lực ion và nhiệt độ
Linh độ điện di sẽ giảm khi tăng lực ion của chất điện giải nền. Hoạt độ ion μ được xác (lịnh theo phương trình:
μ = 0,5∑CiZi2
Trong đó Ci là nồng độ ion (mol/l), Zi là hóa trị và tổng được tính với tất cả các ion trong dung dịch. Đối với dung dịch đệm có cả anion và cation hóa trị 1 thì lực ion được xác định bằng nồng độ mol.
Lực ion của chất điện giải dùng trong điện di nói chung nằm trong dãy từ khoảng 0,01 đến 0,10. Hoạt độ ion thích hợp phụ thuộc một phần vào thành phần của mẫu thử, do đó dung lượng đệm phải đủ lớn để duy trì pH hằng định trên diện tích của các dải hợp phần. Các dải hợp phần trở nên sắc nét hơn và hẹp hơn khi lực ion tăng.
Nhiệt độ ảnh hưởng gián tiếp lên linh độ, vì độ nhớt η của chất điện giải nền phụ thuộc vào nhiệt độ. Độ nhớt của nước sẽ giảm theo tỷ lộ khoảng 3 %/ °C trong vùng từ 0 °C đến 5 °C và tỷ lệ giảm này sẽ thấp hơn khi ở nhiệt độ phòng. Bởi vậy, linh độ điện di sẽ tăng cùng với sự tăng nhiệt độ của chất điện giải.
Nhiệt giải phóng là đáng kể khi dòng điện chạy qua chất điện giải. Nhiệt này tăng cùng với sự tăng thế đặt và lực ion tăng. Ở các thiết bị lớn, cho dù có bộ phận làm lạnh, nhiệt giải phóng vẫn tạo nên sự biến thiên về nhiệt độ ở bể điện di, dẫn đến làm biến dạng các dải phân cách. Bởi vậy, cần quan tâm thiết kế các dụng cụ đặc biệt tính đến lực ion và thế đặt.
Ảnh hưởng của môi trường nền, dòng điện thẩm
Khi dòng điện chạy qua chất điện giải chứa trong ống thủy tinh hoặc chứa giữa các bản thủy tinh hoặc bản plastic thì xuất hiện dòng chất điện giải hướng về phía đầu một điện cực, gọi là dòng điện thẩm. Dòng điện thẩm được hình thành do điện tích trên bề mặt của thành dụng cụ phát sinh do quá trình ion hóa các nhóm chức trong vật liệu hay do các ion hấp phụ trên thành buồng điện di chứa các chất điện giải. Hiệu ứng này thường tăng khi buồng điện di chứa các chất xốp như gel, được sử dụng để làm ổn định cho chất điện giải nền và đề phòng hiện tượng xáo trộn các dải phân tách do sự đối lưu nhiệt và hiện tượng khuếch tán. Dung dịch ngay sát trên bề mặt sẽ hình thành điện tích bằng nhưng ngược dấu với điện tích trên bề mặt và điện trường đi qua buồng điện di sẽ tạo nên sự chuyển động của dung dịch về phía điện cực ngược dấu.
Các chất thường được sử dụng làm môi trường nền trong điện di vùng sẽ tạo diện tích âm trên bề mặt, dòng điện thẩm của chất điện giải sẽ di chuyển về phía cathod. Vì vậy tất cả các vùng, bao gồm cả các chất trung tính sẽ di chuyển về phía cathod trong quá trình điện di.
Mức độ thẩm thấu sẽ thay đổi khi các chất nền thay đổi. Độ thẩm thấu thay đổi đáng kể đối với gel agar và thay đổi không đáng kể đối với gel polyacrylamid.
Sự rây phân tử
Khi không có sự hiện diện của môi trường nền hay trong trường hợp môi trường rất xốp thì sự tách điện di của các phân tử là do sự khác nhau về tỷ lệ của điện tích với kích thước phân tử. Nếu có sự hiện diện của chất nền, sự khác nhau về khả năng hấp phụ hay ái lực của phân tử đối với môi trường tạo nén hiệu ứng sắc ký có thể làm tăng hiệu quả tách.
Hiệu ứng rây phân tử sẽ xuất hiện nếu môi trường nền là các loại gel có sự phân nhánh nhiều đến mức tạo thành các lỗ xốp để tách các phân tử theo kích thước. Hiệu ứng này tương đương hiệu ứng thu được trong quá trình tách thẩm thấu gel hay sắc ký rây phân tử, nhưng trong điện di gel hiệu ứng này chồng lên quá trình tách điện di. Có thể nhận thấy sự rây phân tử độ cản trở không gian đối với sự di chuyển của các phân tử lớn. Các phân tử nhỏ di chuyển qua các lỗ xốp có kích thước lớn, nên sự điện di qua gel không bị cản trở. Khi kích thước phân tử tăng, một số ít hơn các lỗ xốp cho phép các phân tử đi qua, làm chậm sự di chuyển của các phân tử có trọng lượng phân tử lớn.
Điện di gel
Quá trình sử dụng một gel như agar (thạch), tinh bột hay polyacrylamid làm môi trường nền được hiểu theo nghĩa rộng là điện di gel. Phương pháp này đặc biệt thuận lợi cho sự tách các protein. Sự tách này đạt được tùy thuộc vào tỷ lệ điện tích đối với kích thước phân tử đi đôi với hiệu ứng rây phân tử phụ thuộc chủ yếu vào khối lượng phân tử.
Gel polyacrylamid được sử dụng nhiều do có một số thuận lợi. Nó có đặc tính ít hấp phụ và tạo nên hiệu ứng dòng điện thẩm không đáng kể. Các gel với dải rộng các lỗ xốp có kích thước khác nhau có thể được điều chế bằng cách thay đổi nồng độ gel tổng cộng (dựa trên monomer kết hợp với các yếu tố tạo mạch nhánh) và phần trăm của chất tạo mạch nhánh dùng để tạo gel. Lượng các chất được biểu thị bằng phương trình sau:
T (%) = ((a+b)/V) x 100
C (%) = (b/(a+b)) x 100
Trong đó T là nồng độ gel tổng cộng (%), C là phần trăm tác nhân tạo mạch nhánh dùng để tạo gel, V là thế tích (mL) của đệm dùng điều chế gel, a và b là khối lượng (g) của monomer (acrylamid) và tác nhân tạo mạch nhánh (thường dùng N,N’-methylenbisacrylamid) dùng điều chế gel. Các gel thích hợp có nồng độ trong khoảng 3 % – 30 %. Tổng tác nhân tạo mạch nhánh thường chiếm khoảng 1/10 đến 1/20 lượng monomer (C = từ 10 % đến 5 %), tỷ lệ phần trăm nhỏ hơn được dùng cho giá trị cao hơn của T.
Trong quá trình điều chế gel, bể của dụng cụ điện di chứa dung dịch nước của monomer và tác nhân tạo mạch nhánh, thường được cân bằng bằng dung dịch đệm đến pH mong muốn trong những lần chạy cuối và được polymer hóa tại chỗ bằng quá trình gốc tự do. Quá trình polymer hóa được kích hoạt bởi quá trình hóa học, thông thường sử dụng amoni persulfat kết hợp với N,N,N’,N’- tetramethylendiamin hay quang hóa hỗn hợp riboflavin và N,N,N’,N’-tetramethylendiamin. Quá trình polymer hóa bị cản trở bởi các phân tử oxy và môi trường acid. Lựa chọn thành phần của gel và điều kiện polymer hóa phải bảo đảm chất lượng của gel.
Thiết bị cho điện di gel
Nói chung bể hay môi trường để thực hiện quá trình điện di có thể được đặt theo phương thẳng đứng hay nằm ngang tùy theo thiết kế của thiết bị. Để so sánh sự tách có thể thực hiện trong một số ống riêng biệt hay đưa các mẫu khác nhau vào các hố kề bên nhau vào khuôn hay cắt vào phiến của gel. Phiến gel thẳng đứng như mô tả trong Hình 5.6.2 thuận lợi cho sự so sánh trực tiếp một số mẫu.
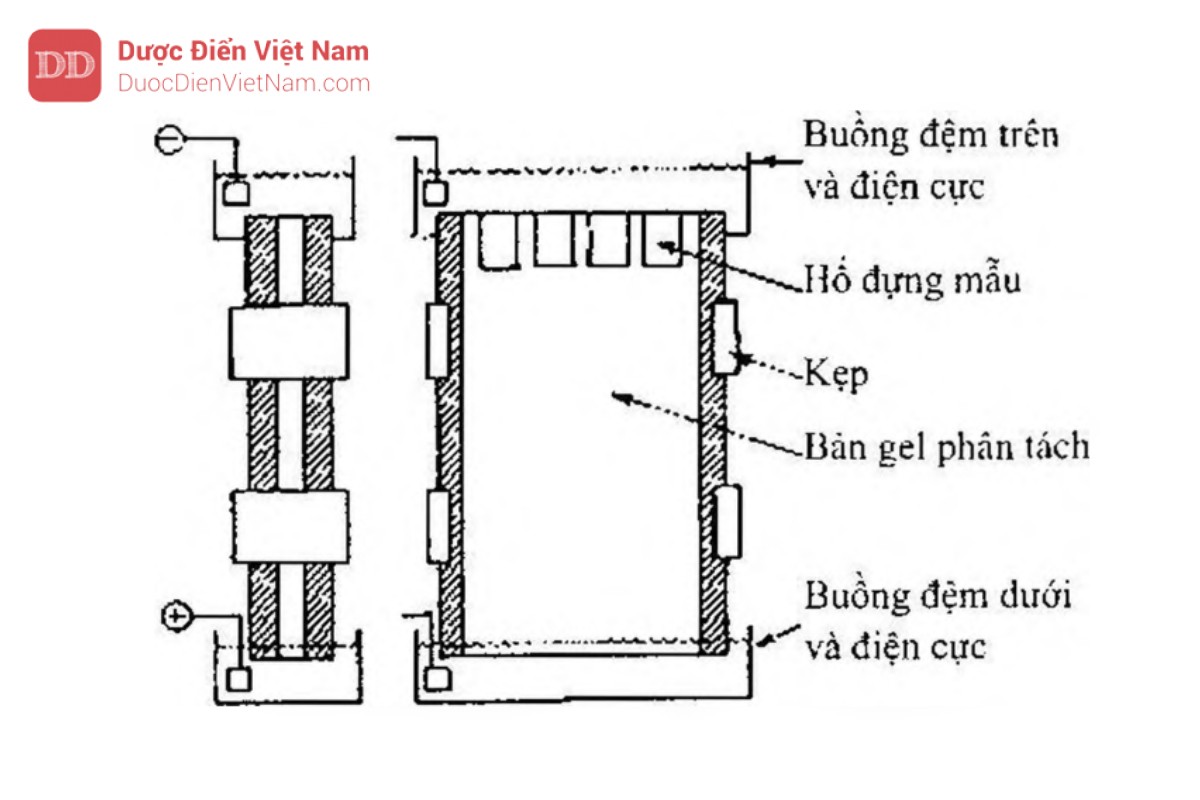
Tốt nhất là sự so sánh các mẫu trong cùng một bàn gel như vậy sẽ đồng nhất hơn về mặt thành phần so với các khuôn gel trong nhiều bể điện di.
Đặc tính của nhiều loại thiết bị là phải hàn kín buồng đệm phía dưới với chân đế của bể điện di, cho phép mức đệm trong buồng đệm phía dưới bằng mức đệm trong buồng đệm phía trên để loại trừ áp suất thủy tĩnh trên gel. Ngoài ra có một vài bộ phận tuần hoàn làm lạnh cả hai mặt bể điện di gel.
Để điều chế gel, buồng gel được đậy bằng nắp thích hợp có chứa dung dịch monomer, tác nhân tạo mạch nhánh và chất xúc tác. Một cái lược có răng với kích thước thích hợp được đặt lên phía trên và cho phép quá trình polymer hóa xảy ra hoàn toàn. Sau khi lấy được ra sẽ tạo thành các hố trên bản gel được polymer hóa.
Trong điện di gel đơn giản, chỉ sử dụng một dung dịch đệm cho vào buồng đệm phía trên và phía dưới giống nhau. Sau khi cho dung dịch đệm vào buồng đệm, mẫu được hòa tan trong nước đường hay dung dịch đặc và hơi nhớt khác để đồ phòng sự khuếch tán. Sau đó mẫu được đưa vào đáy các hố dựng mẫu bằng bơm tiêm hay micropipet và bắt đầu thực hiện quá trình diện di.
Điện di đĩa
Điện di gel polyacrylamid sử dụng một dãy không liên tục các đệm và cũng thường sử dụng nhiều lớp gel không liên tục được gọi là điện di đĩa. Tên của phương pháp xuất phát từ dạng hình dạng đĩa của các dải hẹp được tạo thành. Do tạo thành các dải hẹp, nên kỹ thuật này có độ phân giải đặc biệt cao và thường được sử dụng trong phân tích đặc tính của hỗn hợp protein và phát hiện tạp chất mà có thể có linh độ gần thành phần chính.
Cơ sở của điện di đĩa được trình bày trong phần sau có liên quan đến các hệ anion thích hợp cho việc phân tách protein mang điện tích âm. Để hiểu được điện di đĩa cần phải có kiến thức chung về điện di và dụng cụ đã được mô tả.
Cơ sở của điện di đĩa
Độ phân giải cao thu được trong điện di đĩa phụ thuộc vào việc sử dụng hệ đệm không liên tục về pH và thành phần.
Thường phối hợp hai hoặc ba gel khác nhau về tỷ trọng. Hệ thống điển hình được mô tả trong Hình 5.6.3.
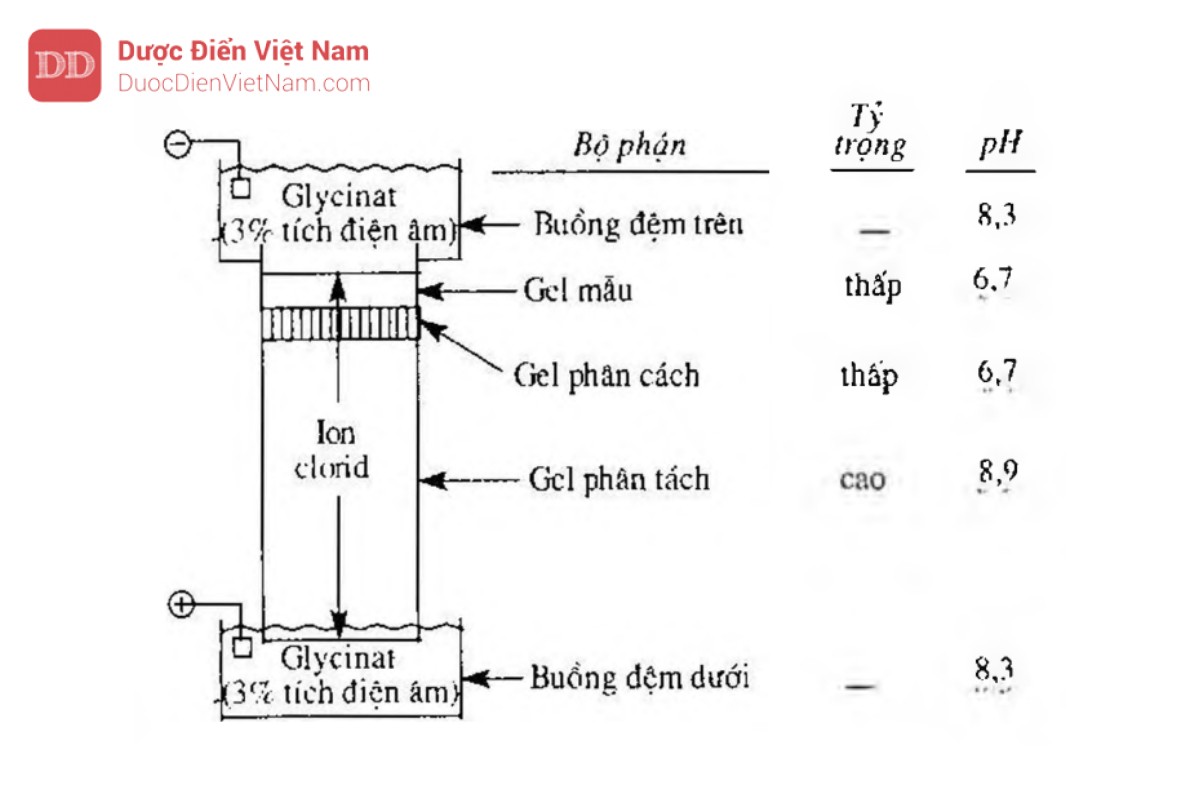
Gel phân tách có chiều cao vài cm với tỷ trọng cao (T = 10 % – 30 %) được polymer hóa trong đệm tris-clorid trong bể của thiết bị. Trong quá trình polymer hóa đệm được phủ lên một lớp nước mỏng để đề phòng hiện tượng tạo thành mặt khum trên bề mặt của gel. Lớp nước phủ lên sau đó được loại đi, lớp gel mỏng tỷ trọng thấp (T = 3 %), có bề dày 3 mm đến 10 mm được gọi là khoảng trống hay gel phân cách, được polymer hóa trong đệm tris-clorid trên mặt của gel phân tách. Lớp nước phủ phía trên lại tiếp tục được sử dụng để tạo mặt phẳng. Mẫu được trộn với một lượng nhỏ dung dịch monomer dùng để tạo gel phân cách, đổ lên mặt của gel phân cách và được polymer hóa. pH của gel phân tách thường là 8,9, trong khi đó pH của gel phân cách và gel chứa mẫu là 6,7. Tất cả ba loại gel này được điều chế dùng clorid làm anion.
Dung dịch đệm chứa trong buồng chứa đệm phía trên và phía dưới có pH là 8,3 và được điều chế từ tris và glycin. pH này khoảng 3 % phân tử glycin mang điện tích âm. Khi đặt điện thế lên hệ thống, lớp tiếp giáp glycinat-clorid sẽ di chuyển theo hướng đi xuống và về phía anod. Lớp tiếp giáp bắt đầu ở vị trí lớp tiếp xúc của buồng chứa đệm phía trên và đỉnh của lớp gel chứa mẫu. Tại đây ion clorid do có kích thước nhỏ nên sẽ di chuyển nhanh hoặc bất kỳ protein nào hiện diện trong mẫu. pH của lớp gel mẫu và lớp gel phân cách được chọn phải thấp hơn giá trị pKa cao của glycin khoảng 3 đơn vị. Do vậy, khi băng qua các lớp gel này, chỉ có khoảng 0,1 % phân tử glycin tích điện âm. Cho nên, glycin sẽ di chuyển chậm hơn clorid. Khuynh hướng dịch chuyển nhanh hơn của clorid khỏi glycinat làm giảm nồng độ nơi tiếp giáp, tạo nên sự giảm thế nhiều hơn ở lớp tiếp giáp, điều này làm cho glycinat bắt kịp ion clorid. Trong điều kiện này, lớp tiếp giáp rất hẹp được duy trì, và khi đó nó di chuyển qua lớp gel mẫu thử và lớp gel phân cách, các protein trong mẫu thử ở lớp tiếp giáp sắp xếp thành lớp rất mỏng theo thứ tự về linh độ. Quá trình này là nguồn gốc của việc các đĩa được phân tách.
Các protein được sắp xếp theo trình tự khi tiếp xúc với gel phân tách tỷ trọng cao, chúng sẽ di chuyển chậm lại do quá trình rây phân tử. pH cao hơn trong gel phân tách làm cho glycinat di chuyển nhanh hơn, đến mức độ làm cho lớp tiếp xúc của các đệm không liên tục sẽ vượt qua các protein và cuối cùng sẽ tiếp xúc với đáy của gel phân tách. Trong chu trình này, các đĩa protein tiếp tục phân tách bằng quá trình điện di và quá trình rây phân tử trong gel phân tách. Kết thúc quá trình tách, pH của gel phân tách số tăng từ giá trị ban đầu là 8,9 lên khoảng pH 9,5.
Linh độ tương đối
Bromophenol xanh thường được sử dụng như là một chuẩn để tính toán linh độ tương đối của các dải phân tách và để quan sát các quá trình tách. Nó có thể được thêm vào trong hố đựng mẫu hoặc trộn lẫn với mẫu, hoặc đơn giản được thêm vào dung dịch đệm ở buồng chứa đệm phía trên.
MB = a/b
Trong đó: a là khoảng cách từ mốc xuất phát đến vùng mẫu và b là khoảng cách từ mốc xuất phát đến vùng bromophenol xanh.
Quan sát các vùng phân tách
Do polyacrylamid trong suốt, nên các dài protein có thể được quan sát bằng đo mật độ quang với ánh sáng UV. Các vùng có thể cố định bằng cách nhúng vào các dung dịch làm tủa protein như acid phosphotungstic hoặc acid tricloracetic 10 %. Các thuốc thử hiện màu được sử dụng bao gồm naphtalen đen (amido đen) và Coomassie lam sáng R250. Những vùng được cố định hay có màu có thể được quan sát một cách thuận lợi và được chụp ảnh với ánh sáng truyền qua từ nguồn phát tia X.
=> Xem thêm: PHƯƠNG PHÁP SẮC KÝ RÂY PHÂN TỬ (Phụ lục 5.5) – Dược Điển Việt Nam 5.
Những điều an toàn cần chú ý
Thế sử dụng trong điện di có thể gây sốc chết người. Nguy cơ này sẽ tăng do sử dụng dung dịch đệm nước và điều kiện môi trường làm việc ẩm ướt.
Bộ phận cung cấp nguồn của thiết bị cần được bao lại trong các lồng kim loại có dây nối đất hoặc cần được chế tạo bằng các vật liệu cách điện, các lồng kim loại này cần có chốt tự cắt nguồn khi mở nắp thiết bị.
Vì sự nguy hiểm của thế cao áp, nhân viên phòng thí nghiệm cần làm quen với thiết bị trước khi sử dụng chúng.