AMPHOTERICIN B (Amophotericincum B) – Dược Điển Việt Nam 5
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyAmphotericin B là một hỗn hợp các polyen chống nấm được sản xuất bằng cách nuôi cấy một số giống Streptomyces nodosus hoặc bằng các phương pháp khác, chứa chủ yếu là amphotericin B.
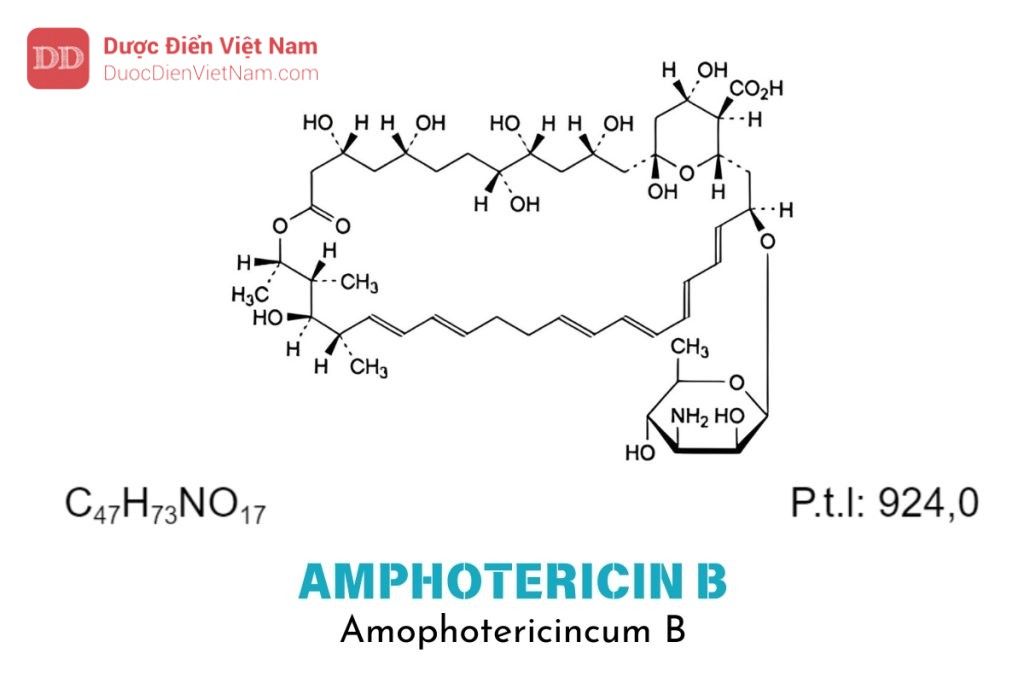
Amphotericin B là: Acid (1R,3S,5R,6R,9R,11R,15S,16R,17R,18S,19E,21E,23E,25E,27E,29E,31E,33R,35S,36R,37S)-33-[(3-amino-3,6-dideoxy-β-D-mannopyranosyl)oxy]-1,3,5,6,9,11,17,37-octahydroxy-15,16,18-trimethyl-13-oxo-14,39-dioxabicyclo-[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaen-36 carboxylic.
Hoạt lực của chế phẩm không được nhỏ hơn 750 IU/mg, tính theo chế phẩm đã làm khô.
Tính chất
Bột màu vàng hoặc da cam, hút ẩm.
Thực tế không tan trong nước và ethanol 96 %, tan trong dimethyl sulfoxyd và propylen glycol, khó tan trong dimethylformamid, rất khó tan trong methanol.
Dung dịch chế phẩm loãng nhạy cảm với ánh sáng.
Định tính AMPHOTERICIN B
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, D.
Nhóm II: B, C.
A. Phổ hấp thụ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hấp thụ hồng ngoại của amphotericin B chuẩn. Nếu phổ của chế phẩm khác với phổ của chất chuẩn thì sấy chế phẩm và chất chuẩn ở 60 °C, áp suất không quá 0,7 kPa trong 1 h và tiến hành đo phổ mới.
B. Hòa tan 25 mg chế phẩm trong 5 mi dimethyl sulfoxyd (TT) và pha loãng thành 50 ml bằng methanol (TT). Pha loãng 2 ml dung dịch này thành 200 ml bằng methanol(TT). Phổ hấp thụ tử ngoại khả kiến (Phụ lục 4.1) của dung dịch thu được trong khoảng bước sóng từ 300 nm đến 450 nm cho 3 cực đại hấp thụ ở bước sóng 362 nm, 381 nm và 405 nm.
Tỷ số giữa độ hấp thụ ở bước sóng 362 nm và bước sóng 381 nm phải từ 0,57 đến 0,61. Tỷ số giữa độ hấp thụ ở bước sóng 381 nm và bước sóng 405 nm phải từ 0,87 đến 0,93.
C. Thêm 5 ml acid phosphoric (TT) vào 1 ml dung dịch chế phẩm 0,05 % trong dimethyl sulfoxyd (TT) sao cho lớp acid nằm ở bên dưới, tránh làm trộn lẫn 2 lớp chất lỏng. Một vòng màu xanh lam xuất hiện ngay lập tức ở mặt tiếp xúc giữa 2 lớp chất lỏng. Lắc, màu xanh lam đậm được tạo thành. Thêm 15 ml nước và lắc, dung dịch sẽ chuyển thành màu vàng nhạt.
D. Trong phần Tạp chất liên quan, thời gian lưu của pic chính thu được trên sắc ký đồ của dung dịch thử tại bước sóng 383 nm phải giống thời gian lưu của pic chính thu được trên sắc ký đồ của dung dịch đối chiếu (1).
=> Đọc thêm: VIÊN NÉN AMOXICILIN VÀ ACID CLAVULANIC (Tabellae Amoxicillini et Acidi clavulanici) – Dược Điển Việt Nam 5.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3). Tránh ánh sáng khi chuẩn bị các dung dịch và sử dụng trong vòng 24 h, trừ dung dịch đối chiếu (3) phải tiêm ngay sau khi pha.
Pha động A: Methanol – acetonitril – dung dịch đệm pH 4,7 (1 : 3 : 6).
Pha động B: Methanol – dung dịch đệm pH 3,9 – acetonitril (12 : 20 : 68).
Dung dịch đệm pH 3,9: Dung dịch acid citric 0,42 % được điều chỉnh đến pH 3,9 bằng amoniac đậm đặc (TT).
Dung dịch đệm pH 4,7: Dung dịch acid citric 0,42 % được điều chỉnh đến pH 4,7 bằng amoniac đậm đặc (TT).
Hỗn hợp dung môi: Dung dịch amoni acetat 1 % – N-methylpyrolidon – methanol (1 : 1 : 2).
Dung dịch thử: Hòa tan 20,0 mg chế phẩm trong 15 ml N-methylpyrolidon (TT), trong vòng 2 h pha loãng thành 50,0 ml bằng hỗn hợp dung môi. Pha loãng 5,0 ml dung dịch thu được thành 25,0 ml bằng hỗn hợp dung môi.
Dung dịch đối chiếu (1): Hòa tan 20,0 mg amphotericin B chuẩn trong 15 ml N-methylpyrolidon (TT), trong vòng 2 h pha loãng thành 50,0 ml bằng hỗn hợp dung môi. Pha loãng 5,0 ml dung dịch thu được thành 25,0 ml bằng hỗn hợp dung môi.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch đối chiếu (1) thành 100,0 ml bằng hỗn hợp dung môi.
Dung dịch đối chiếu (3): Hòa tan 20,0 mg nystatin chuẩn trong 15 ml N-methylpyrolidon (TT), trong vòng 2 h pha loãng thành 50,0 ml bằng hỗn hợp dung môi. Pha loãng 5,0 ml dung dịch thu được thành 25,0 ml bằng dung dịch đối chiếu (1). Pha loãng 2,0 ml dung dịch thu được thành 100,0 ml bằng hỗn hợp dung môi.
Dung dịch đối chiếu (4): Để tạo ra tạp chất B và C, hòa tan 10 mg chế phẩm trong 5 ml N-methylpyrolidon (TT), trong vòng 2 h thêm 35 ml hỗn hợp methanol – ethanol (1 : 4), thêm 0,10 ml dung dịch acid hydrocloric loãng (TT) trộn đều và ủ ở 25 °C trong 2,5 h. Thêm 10 ml dung dịch amoni acetat 1% và trộn đều.
Dung dịch đối chiếu (5): Hòa tan 4 mg amphotericin B chuẩn dùng để định tính pic (chứa tạp chất A và B) trong 5 ml N-methylpyrolidon (TT) trong vòng 2 h pha loãng thành 50 ml bằng hỗn hợp dung môi.
Dung dịch mẫu trắng: Hỗn hợp dung môi.
Điều kiện sắc ký:
Cột kích thước (15 cm x 4,6 min) được nhồi pha tĩnh base-deactivated end-capped octadecylsilyl silica gel dùng cho sắc ký (3 µm).
Nhiệt độ cột: 20 °C.
Detector quang phổ tử ngoại đặt tại bước sóng 303 nm để phát hiện các tetraen, tại bước sóng 383 nm để phát hiện các heptaen.
Tốc độ dòng: 0,8 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiến hành sắc ký theo chương trình dung môi như sau:
| Thời gian (min) | Pha động A (% tt/tt) | Pha động B (% tt/tt) |
| 0-3 | 100 | 0 |
| 3-23 | 100 → 70 | 0 → 30 |
| 23-33 | 70 → 0 | 30 → 100 |
| 33-40 | 0 | 100 |
Tiến hành sắc ký với dung dịch thử, dung dịch đối chiếu (2), (3), (4) và (5).
Định tính các tạp chất: Sử dụng sắc ký đồ cung cấp kèm theo amphotericin B chuẩn dùng để định tính pic và sắc ký đồ của dung dịch đối chiếu (5) để xác định pic của tạp chất A và tạp chất B.
Thời gian lưu tương đối so với amphotericin B (thời gian lưu khoảng 16 min): Tạp chất B khoảng 0,75; tạp chất A khoảng 0,8; nystatin khoảng 0,85.
Kiểm tra tính phù hợp của hệ thống tại bước sóng 383 nm:
Trên sắc ký đồ của dung dịch đối chiếu (4), độ phân giải giữa 2 pic có thời gian lưu tương đối khoảng 0,7 ít nhất là 1,5.
Giới hạn:
Tại bước sóng 303 nm:
Tạp chất A: Diện tích pic tạp chất A không được lớn hơn 2,5 lần diện tích pic chính thu được trên sắc ký đồ của dung dịch đối chiếu (3) (5,0 %); nếu sử dụng để sản xuất thuốc tiêm thì diện tích pic tạp chất A không được lớn hơn diện tích pic chính thu được trên sắc ký đồ của dung dịch đối chiếu (3) (2,0 %).
Các tạp chất khác: Với mỗi tạp chất, diện tích pic không được lớn hơn 0,5 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (3) (1,0 %).
Bỏ qua những pic có diện tích nhỏ hơn 0,05 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (3) (0,1 %).
Tại bước sóng 383 nm:
Tạp chất B: Diện tích pic tạp chất B không được lớn hơn 4 lần diện tích pic chính thu được trên sắc ký đồ của dung dịch đối chiếu (2) (4,0 %).
Các tạp chất khác: Với mỗi tạp chất, diện tích pic không được lớn hơn 2 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (2,0 %).
Tổng các tạp chất ở bước sóng 303 nm và bước sóng 383 nm: Không được lớn hơn 15,0 %.
Bỏ qua những pic có diện tích nhỏ hơn 0,1 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (0,1 %).
Ghi chú:
Tạp chất A: Amphotericin A (28,29-dihydro-amphotericin B).
Tạp chất B: Amphotericin X1 (13-O-methyl-amphotericin B).
Tạp chất C: Amphotericin X2 (13-O-ethyl-amphotericin B)
Mất khối lượng do làm khô
Không được quá 5,0 % (Phụ lục 9.6).
(1 000 g; áp suất không quá 0,7 kPa; 60 °C).
=> Xem thêm: NANG AMOXICILIN VÀ CLOXACILIN (Capsulae Amoxicillini et Cloxacillini) – Dược Điển Việt Nam 5.
Tro sulfat
Không được quá 3,0 % và không được quá 0,5 % khi sử dụng để sản xuất thuốc tiêm (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Nội độc tố vi khuẩn
Không được quá 1,0 EU/mg nếu sử dụng để sản xuất thuốc tiêm mà không có biện pháp hữu hiệu để loại bỏ nội độc tố vi khuẩn (Phụ lục 13.2).
Định lượng Amphotericin B
Trong quá trình định lượng, tất cả các dung dịch phải tránh ánh sáng.
Hòa tan 25,0 mg chế phẩm trong dimethyl sulfoxid (T T) và vừa lắc vừa thêm dung môi này đến vừa đủ 25,0 ml. Lắc dung dịch gốc liên tục và từ dung dịch gốc này pha loãng bằng dimethyl sulfoxid (TT) để thu được các dung dịch có nồng độ thích hợp (44,4; 66,7 và 100 IU/ml). Dung dịch cuối cùng được chuẩn bị bằng cách pha loãng 20 lần các dung dịch trên bằng dung dịch đệm số 14 (Phụ lục 13.9) vì vậy các dung dịch cuối cùng có chứa 5 % (tt/tt) dimethyl sulfoxid (TT). Chuẩn bị đồng thời dung dịch chuẩn và dung dịch thử trong cùng một điều kiện. Tiến hành “Xác định hoạt lực thuốc kháng sinh bằng phương pháp thử vi sinh vật” (Phụ lục 13.9).
Bảo quản
Trong bao bì kín, tránh ánh sáng và giữ ở nhiệt độ 2 °C đến 8 °C. Nếu chế phẩm vô trùng, bảo quản trong bao bì vô trùng, kín.
Nhãn
Trên nhãn phải ghi rõ nếu dùng để sản xuất thuốc tiêm.
Loại thuốc
Chống nấm.
Chế phẩm
Viên ngậm. Hỗn dịch uống.