Thử nghiệm nhận dạng thành phần bạch hầu – uốn ván – ho gà trong vắc xin DTwP hấp phụ (Phụ lục 15.19) – Dược Điển Việt Nam 5
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyCác thành phần bạch hầu, uốn ván, ho gà toàn tế bào trong vắc xin DTwP hấp phụ được tiến hành kiểm tra nhận dạng theo các bước như sau:
Giải hấp phụ
Vắc xin Bạch hầu – uốn ván – Ho gà (toàn tế bào) hấp phụ được tách gel bằng cách cho thêm natri citrat với nồng độ 5 % ủ ở 37 °C trong 48 h. Sau đó ly tâm 2000 r/min trong 15 min. Hoặc ly tâm vắc xin ở 3000 r/min. Cho dung dịch EDTA-natri phosphat vào phần kết tủa sau ly lâm với nồng độ 20 %. Đánh đều tạo dung dịch đồng nhất. Ủ ở 37 °C trong 18 h. Ly tâm 3000 r/min trong 10 min. Nước nổi được dùng làm dung dịch kiểm tra. Nước nổi được dùng để nhận dạng thành phần bạch hầu và uốn ván bằng phản ứng lên bông, cặn ly tâm dùng để nhận dạng thành phần ho gà có trong vắc xin bằng phản ứng ngưng kết trên phiến kính với các huyết thanh kháng ho gà đặc hiệu.
=> Đọc thêm: Xác định hiệu giá huyết thanh kháng dại (Phụ lục 15.17) – Dược Điển Việt Nam 5.
Nhận dạng thành phần bạch hầu và uốn ván
Phương pháp lên bông
Phương pháp tiến hành (phản ứng lên bông)
Dùng 5 ống nghiệm thủy tinh có đường kính 10 mm, đánh số thứ tự từ 1 đến 5 để làm thử nghiệm kiểm tra sự có mặt của thành phần bạch hầu.
Dùng 5 ống nghiệm thủy tinh khác có đường kính 10 mm, đánh số thứ tự từ 6 đến 10 để làm thử nghiệm kiểm tra sự có mặt của thành phần uốn ván.
Huyết thanh chuẩn kháng độc tố bạch hầu hoặc uốn ván được pha loãng đến nồng độ 20 IU/ml.
Cho vào dãy ống nghiệm từ 1 đến 5 lượng huyết thanh chuẩn kháng độc tố bạch hầu tăng dần đều trong khoảng tương ứng với lượng kháng nguyên giải độc tố bạch hầu có trong nước nổi vắc xin. Tương tự, cho vào dãy ống nghiệm từ 6 đến 10 lượng huyết thanh chuẩn kháng độc tố uốn ván tăng dần đều trong khoảng tương ứng với lượng kháng nguyên giải độc tố uốn ván có trong nước nổi vắc xin.
Thêm nước muối sinh lý vào các ống cho đủ 1 ml.
Cho vào mỗi ống nghiệm 1 ml nước nổi.
Đậy các ống nghiệm bằng giấy parafin. Lắc đều và đặt vào nồi cách thủy ở nhiệt độ 45 °C. Quan sát liên tục dưới ánh đèn, ghi nhận thời gian của ống nghiệm đầu tiên xuất hiện sự lên bông và khoảng thời gian lên bông (Kf).
Đánh giá kết quả
Hàm lượng Lf/ml của thành phần bạch hầu hoặc uốn ván tính theo công thức:
Lf/ml = (Vc x a)/b
Trong đó:
Vc là thể tích huyết thanh chuẩn kháng độc tố ở ống đầu tiên có sự lên bông (ml).
a là số đơn vị huyết thanh chuẩn kháng độc tố (lU/ml).
b là số ml nước nổi.
Hiện tượng lên bông xảy ra chỉ chứng tỏ trong mẫu thử nghiệm có chứa giải độc tố bạch hầu hoặc uốn ván chứ không phản ánh công hiệu của giải độc tố.
Ví dụ
Lượng huyết thanh chuẩn kháng độc tố bạch hầu (20 IU/ml) và lượng huyết thanh chuẩn kháng độc tố uốn ván (20 IU/ml) được cho vào các ống như sơ đồ sau:
| Ống số | Thể tích huyết thanh (ml) | Ống số | Thể tích (ml) |
| 1 | 0,3 | 6 | 0,16 |
| 2 | 0,4 | 7 | 0,18 |
| 3 | 0,5 | 8 | 0,20 |
| 4 | 0,6 | 9 | 0,22 |
| 5 | 0,7 | 10 | 0,24 |
Ống số 3 lên bông đầu tiên tức hàm lượng Lf/ml của thành phần bạch hầu có trong 1 ml vắc xin thử là:
(0,5 ml huyết thanh x 20 IU/ml)/1 ml = 10 Lf/ml
Tương tự, nếu thấy ống số 8 lên bông đầu tiên có nghĩa là hàm lượng Lf/ml của thành phần uốn ván có trong 1 ml vắc xin thử là 4 Lf/ml.
Hiện tượng lên bông xảy ra ở ví dụ này chứng tỏ trong mẫu thử nghiệm có chứa giải độc tố bạch hầu hoặc uốn ván chứ không phản ánh công hiệu của giải độc tố.
Phương pháp khuyếch tán miễn dịch kép trên thạch – Ouchteriony
Chuẩn bị các dung dịch:
Dung dịch 1 : Dung dịch đệm Helena buffer
Cân 18 g đệm Helena Buffer, hòa tan trong nước cất 3 lần, pha loãng vừa đủ 1500 ml với cùng dung môi.
Dung dịch 2: Dung dịch EDTA 0,15 M, được pha như sau:
Cân 2,8 g EDTA, hoà tan trong 40 ml nước cất, sau đó điều chỉnh pH về 8,0 ± 0,3 bằng dung dịch natri hydroxyd (TT), thêm vừa đủ 50 ml dung dịch bằng nước cất. Sử dụng trong vòng 1 tháng kể từ ngày pha.
Dung dịch 3: Dung dịch dinatri hydrophosphat 0,25 M, được pha như sau: Cân 4,45 g dinatri hydro phosphat (TT), hòa tan hoàn toàn trong 80 ml nước cất, thêm nước cất vừa đủ 100 ml. Sử dụng trong vòng 1 tháng kể từ ngày pha.
Dung dịch 4: Hỗn hợp bao gồm 0,1 ml dung dịch EDTA và 4,9 ml dung dịch dinatri phosphat.
Dung dịch 5: Pha loãng dung dịch kháng huyết thanh uốn ván (NIBSC, 66/21, 1400 IU/ống) trong 14 ml nước cất pha tiêm để tạo thành 100 IU/ml lấy ra mỗi tuýp ly tâm 500 μl, sau đó bảo quản ở nhiệt độ dưới -20 °C.
Dung dịch 6: Pha loãng giải độc tố uốn ván chuẩn (NIBSC, TEFT, 1000 Lf/ống) trong 10 ml nước cất pha tiêm để tạo thành 100 IU/ml, lấy ra mồi tuýp ly tâm 500 μl, sau đó bảo quản ở nhiệt độ dưới -20 °C.
Giải hấp phụ
Ly tâm 5 ml vắc xin cần kiểm tra ở 3000 r/min trong 10 min. Lấy 1 ml Dung dịch 4 cho vào phần kết tủa sau khi ly tâm, trộn đều (bằng voltex) để tạo được dung dịch đồng nhất. Để dung dịch thu được trong tủ ấm ở (37±1) °C ít nhất 18 h. Tiếp tục ly tâm dung dịch ở 3000 r/min trong 10 min. Chuyển phần dịch nổi sang 1 ống sạch làm dung dịch kiểm tra.
Tiến hành
Làm tan hoàn toàn (đến khi dung dịch trong suốt) dung dịch agarose 1 % trong Dung dịch 1 bằng lò vi sóng hoặc đun cách thủy, để nguội đến (56 ± 1) °C.
Dùng pipet 25 ml chuyển 18 ml dung dịch agarose sang bản phim gelbond đã được cố định bằng khuôn thạch.
Để mẫu cố định trong 15 min (có thể đặt vào tủ lạnh nếu cần).
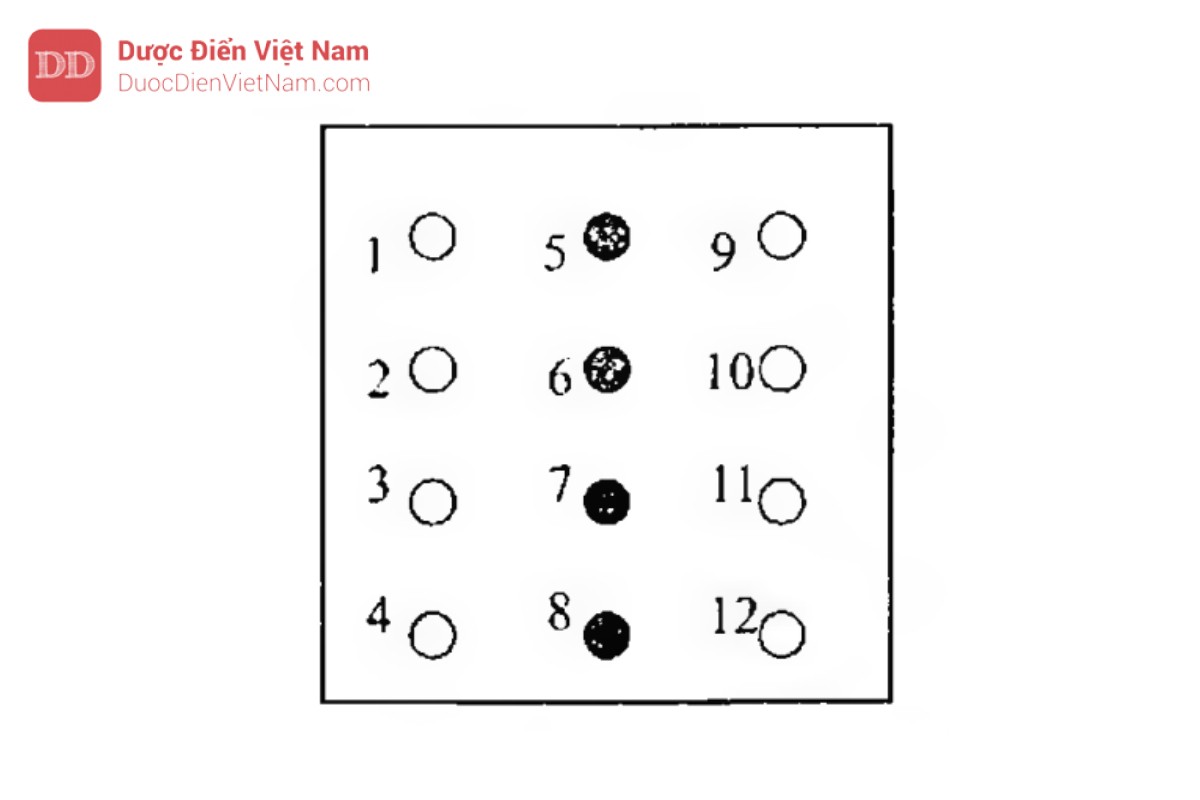
Đục bản gel thành các giếng có đường kính 4 mm, như chỉ dẫn ở hình sau:
Nhỏ 10 μl antitoxin/antiserum Dung dịch 5 vào giếng 5; 6; 7; 8.
Nhỏ 20 μl Dung dịch kiểm tra (mẫu thử) vào giếng 1; 2; 3 và 10 μl vào giếng 9; 10; 11.
Nhỏ 10 μl Dung dịch 6 (chứng dương) vào giếng 4, 10μl chứng âm (dd 7) vào giếng 12.
Đặt bản gel vào buồng ẩm bão hòa hơi nước trong 48 h.
Làm khô hoàn toàn bản gel (cho đến khi bản gel trong suốt) bằng giấy thấm nước.
Nhuộm màu: Ngâm bản gel trong dung dịch Coomassie stain solution (1X) 10 min, trong quá trình ngâm lắc nhẹ bản gel bằng máy lắc ngang.
Tẩy màu: Chuyển bản gel vào bình chứa dung dịch Destain solution Coomassie R-250 (1X). Lắc nhẹ bản gel trong 5 min.
Rửa lại bản gel bằng nước cất.
Để khô, đọc kết quả.
Đọc kết quả
Quan sát đường tủa màu xanh của kháng thể uốn ván chuẩn với giải độc tố uốn ván trong vắc xin tại vị trí Dung dịch kiểm tra (trong khoảng giữa giếng 1 và 9 với giếng 5, khoảng giữa giếng 2 và 10 với giếng 6, khoảng giữa giếng 3 và 11 với giếng 7).
Tiêu chuẩn đánh giá
Thử nghiệm có giá trị khi tuân thủ đúng quy trình (các yếu tố, điều kiện của quá trình thực hiện là đảm bảo không ảnh hưởng đến kết quả thí nghiệm).
Tại chứng dương, xuất hiện đường tủa của kháng thể uốn ván chuẩn với giải độc tố uốn ván chuẩn.
Tại chứng âm, không xuất hiện đường tủa.
Thử nghiệm được coi là có giá trị khi thỏa mãn cả 3 tiêu chuẩn trên. Nếu không thỏa mãn 1 trong 3 tiêu chuẩn, thử nghiệm được coi là không có giá trị.
Đánh giá
Vắc xin được coi là đạt tiêu chuẩn khi tại vị trí kiểm tra dung dịch (trong khoảng giữa giếng 1 và 9 với giếng 5, khoảng giữa giếng 2 và 10 với giếng 6, khoảng giữa giếng 3 và 11 với giếng 7) xuất hiện đường tủa màu xanh của kháng thể uốn ván chuẩn với giải độc tố uốn ván trong vắc xin.
Nếu kết quả không đạt mà thử nghiệm không có giá trị, lặp lại thử nghiệm như lần đầu.
Nếu kết quả không đạt mà thử nghiệm có giá trị thì lặp lại thử nghiệm với số lượng mẫu gấp đôi lần đầu. Ở lần lặp lại, vắc xin được coi là đạt tiêu chuẩn khi tại vị trí kiểm tra dung dịch (trong khoảng giữa giếng 1 và 9 với giếng 5, khoảng giữa giếng 2 và 10 với giếng 6, khoảng giữa giếng 3 và 11 với giếng 7) xuất hiện đường tủa màu xanh của kháng thể uốn ván chuẩn với giải độc tố uốn ván trong vắc xin. Vắc xin được coi là không đạt yêu cầu khi không có đường kết tủa ở các vị trí trên.
=> Đọc thêm: Xác định hàm lượng nitơ toàn phần của vắc xin và sinh phẩm bằng thuốc thử Nessler (Phụ lục 15.18) – Dược Điển Việt Nam 5.
Nhận dạng thành phần ho gà trong vắc xin DTwP
Cặn của vắc xin DTP hấp phụ sau khi ly tâm được ngưng kết trên phiến kính với kháng huyết thanh ho gà đặc hiệu týp 1, 2, 3.
Hiện tượng ngưng kết xảy ra chứng tỏ trong mẫu thử nghiệm có chứa vi khuẩn ho gà.
Tiêu chuẩn chấp thuận
Có hiện tượng lên bông khi làm phản ứng với huyết thanh chuẩn kháng độc tố bạch hầu, uốn ván và có phản ứng ngưng kết với huyết thanh chuẩn ho gà đặc hiệu týp 1, 2, 3.
Hàm lượng Lf/ml của giải độc tố bạch hầu ≤ 30 Lf/ml.
Hàm lượng Lf/ml của giải độc tố uốn ván ≤ 10 Lf/ml.