VANCOMYCIN HYDROCLORID (Vancomycini hydrochloridum) – Dược Điển Việt Nam 5
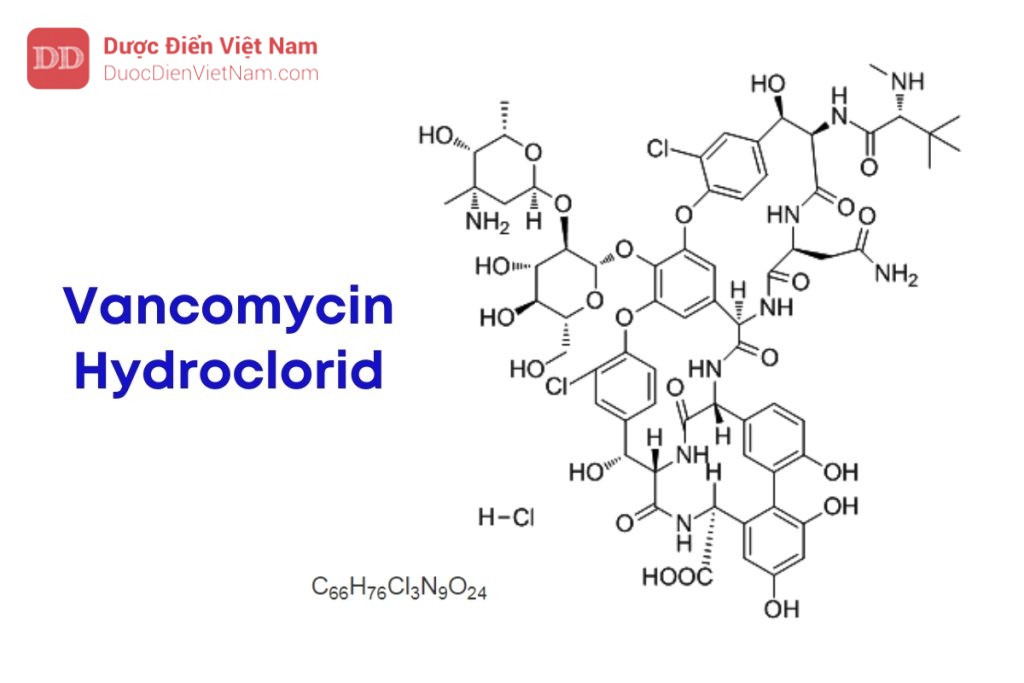
Nếu nội dung bài viết chưa chính xác, vui lòng thông báo cho chúng tôi tại đâyVancomycin hydroclorid là muối hydrocìorid của hỗn hợp các glycopeptid có liên quan với nhau, chủ yếu dưới dạng mono hydroclorid của (3S,6R,7R,22R,23S, 26S,aS,36R,38aR)-3-(2-amino-2-oxoethyl)-44-[[2-O3-amino-2,3,6-trideoxy-3-C-methyi-α-L-lyxo-hexo-pyranosyl)-β-D-glucopyranosyl]oxy]-10,19-dicloro-7,22,28,30,32-pentahydroxy-6-[[(2R)-4-methyl-2-
(methyIamino)-pentanoyl]amino]-2,5,24,38,39-pentaoxo-2,3,4,5,6,7,23,24,25,26,36,37,38,38a-tetradecahydro-22H-8,11,18,21-dietheno-23,36-(iminomethano)-13,16:31,35-dime-theno-1H,13H[1,6,9]oxadiazacyclo-hexadecino[4,5m][10,2,16]benzoxadiaza-cyclotetracosin-26-carboxylic acid (vancomycin B).
Vancomycin hydroclorid được điều chế từ một số loài Amycolaptosis orientalis hoặc bằng phương pháp khác.
Hoạt lực không được ít hơn 1050 IU/mg, tính theo chế phẩm đã làm khô.
Tính chất
Bột trắng hoặc gần như trắng, dễ hút ẩm. Dễ tan trong nước, khó tan trong ethanol 96 %.
Định tính
A. Trong phần Vancomycin B, thời gian lưu của pic chính trong sắc ký đồ thu được từ dung dịch thử (1) tương đương với thời gian lưu của pic chính trên sắc ký đồ của dung dịch đối chiếu.
B. Chế phẩm phải cho phản ứng (A) của clorid (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Hòa tan 2,5 g chể phẩm trong nước và pha loãng thành 25 ml với cùng dung môi.
Dung dịch thu được phải trong (Phụ lục 9.2). Độ hấp thụ (Phụ lục 4.1) của dung dịch trên đo ở bước sóng 450 mn không được lớn hơn 0,10.
pH
Hòa tan 0,50 g chế phẩm trong nước không có carbon dioxyd (TT) và pha loãng thành 10 ml với cùng dung môi.
pH của dung dịch phải từ 2,5 đến 4,5 (Phụ lục 6.2).
Vancomycin B
Không được ít hơn 93,0 %,
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động A: Thêm 1996 ml nước vào 4,0 ml triethylamin (TT) và chỉnh đến pH 3,2 bằng acid phosphoric (TT). Lấy 920 ml dung dịch vừa pha, thêm 10 ml tetrahydrofuran (TT) và 70 ml acetonitril (TT).
Pha động B: Thêm 1996 ml nước vào 4,0 ml triethylamin (TT) và chỉnh đến pH 3,2 bằng acid phosphoric (TT). Lấy 700 ml dung dịch vừa pha, thêm 10 ml tetrahydrofuran (TT) và 290 ml acetonitril (TT).
Dung dịch thử (1): Hòa tan 10,0 mg chế phẩm trong pha động A và pha loãng thành 5,0 ml với cùng dung môi.
Dung dịch thử (2): Pha loãng 2,0 ml dung dịch thử (1) thành 50,0 ml bằng pha động A.
Dung dịch thử (3): Pha loãng 0,5 ml dung dịch thử (2) thành 20,0 ml bằng pha động A.
Dung dịch đối chiếu: Hòa tan 5,0mg vancomycin hydroclorid chuẩn trong 4 ml nước và pha loãng thành 10 ml với cùng dung môi. Đun nóng ở 65°C trong 24 h. Để nguội.
Dùng các dung dịch này trong vòng 4 h sau khi pha chế.
Điều kiện sắc ký:
- Cột kích thước (25 cm x 4,6 mm), được nhồi pha tĩnh C (5µm).
- Tốc độ dòng: 1,0 ml/min.
- Detector quang pho từ ngoại đặt bước sóng ở 280 nm.
- Thể tích tiêm: 20 µl.
Cách tiến hành:
Rửa giải cột khởi đầu với pha động A. Sau 13 min, tiến hành rửa giải gradient tăng dần nồng độ pha động B khoảng 11 % (tt/tt) cho mỗi phút. Cuối cùng, rửa giải cột trong 4 min, bằng pha động B.
Tiêm dung dịch thử (3). Phép thừ chỉ có giá trị khi pic chính trong sắc ký đồ thu được có giá trị tỉ số giữa tín hiệu và nhiễu đường nền nhỏ nhẩt là 5.
Tiêm dung dịch thử (2). Phép thử này chỉ có giá trị khi hệ số đối xứng của pic vancornycin tối đa là 1,6. Tiêm dung dịch đối chiếu. Phép thử này chỉ có giá trị khi độ phân giải giữa 2 pic chính ít nhất là 5,0. Tiêm dung dịch thử (1).
Tính kết quả hàm lượng phần trăm vancomycin B hydroclorid theo công thức sau:
Ab x 100
Ab + (At/25)
Trong đó:
- Ab là diện tích pic vancomycin B trong sắc ký đồ của dung dịch thử (2).
- At là tổng diện tích tất cả các pic tạp chất trong sắc ký đồ của dung dịch thử (1).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3), như mô tả trong phần Vancomycin B.
Tiêm riêng rẽ dung dịch thử (1), dung dịch thử (2) và dung dịch thử (3).
Tính hàm lượng phần trăm cho mỗi tạp chất bằng công thức sau:
(Ai/25) x 100
Ab + (At/25)
Trong đó:
- Ai là diện tích pic của tạp chất trên sắc ký đồ thu được từ dung dịch thử (1);
- Ab là diện tích pic vancomycin B trong sắc ký đồ thu được từ dung dịch thử (2);
- At là tổng diện tích tất cả các pic tạp chất trong sắc ký đồ thu được từ dung dịch thử (1).
Hàm lượng các chất không phải là các tạp chất như mô tả phải lớn hơn 4,0% và hàm lượng tạp chất toàn phần không được nhiều hơn 7,0 %. Không tính đến những pic có diện tích nhỏ hơn diện tích pic chính trong sắc ký đồ của dung dịch thử (3).
Xem thêm: BỘT PHA TIÊM VANCOMYCIN (Vancomycini pulvis ad injectionem) – Dược Điển Việt Nam 5
Kim loại nặng
Không được quá 30 phần triệu (Phụ lục 9.4.8).
Dùng 1,0 g chế phẩm thử theo phương pháp 3. Dùng 3,0 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Nước
Không được quá 5,0 % (Phụ lục 10.3).
Dùng 0,5 g chế phẩm.
Tro sulfat
Không được quá 1,0 % (Phụ lục 9.9).
Dùng 1,0 g chế phẩm.
Thử vô khuẩn
Nếu chế phẩm dự định dùng làm nguyên liệu để bào chế thuốc tiêm mà không có giai đoạn tiệt khuẩn trong qui trình sản xuất, chế phẩm phải đạt chỉ tiêu về độ vô khuẩn (Phụ lục 15.4).
Nội độc tố vi khuẩn
Không được quá 0,25 EU/mg (Phụ lục 13.2). Nếu dự định dùng làm nguyên liệu để bào chế thuốc tiêm phân liều mà không có giai đoạn loại bỏ nội độc tố vi khuẩn thích hợp trong qui trình sản xuất, chế phẩm phải đạt chỉ tiêu về nội độc tố vi khuẩn.
Định lượng
Tiến hành theo phương pháp xác định hoạt lực kháng sinh bằng phương pháp thử vi sinh vật (Phụ lục 13.9). Dùng vancomycin hydroclorid chuẩn làm chất đối chiếu.
Bảo quản
Trong chai lọ kín, tránh ánh sáng. Nếu dã được tiệt trùng trước, phải bào quàn trong chai lọ kín và vô trùng.
Nhãn
Nhãn ghi rõ chế phẩm đã được tiệt trùng, không có nội độc tố vi khuẩn.
Loại thuốc
Kháng sinh.
Chế phẩm
Thuốc tiêm, thuốc nang.